
Здравствуй, дорогой друг! |
Рады приветствовать тебя в нашем мире химических экспериментов! Здесь, среди колб и пробирок, ты найдешь множество удивительных открытий и познакомитесь с тайнами, скрытые в атомах и молекулах.
Рады приветствовать тебя в нашем мире химических экспериментов! Здесь, среди колб и пробирок, ты найдешь множество удивительных открытий и познакомитесь с тайнами, скрытые в атомах и молекулах.
Готов к новым исследованиям?
Тогда открой для себя магию химических реакций и погрузись в увлекательный мир науки!
Добро пожаловать в наше химическое царство!
Тогда открой для себя магию химических реакций и погрузись в увлекательный мир науки!
Добро пожаловать в наше химическое царство!
Прежде чем начнём...
Давайте проверим, насколько внимательно вы изучили технику безопасности и правила работы с лабораторным оборудованием.
Давайте проверим, насколько внимательно вы изучили технику безопасности и правила работы с лабораторным оборудованием.






В случае разлива химического вещества необходимо немедленно сообщить об этом взрослым.
Утверждение № 1




Ой-ой-ой!
Кажется, ты немного поспешил и выбрал неправильный ответ
Кажется, ты немного поспешил и выбрал неправильный ответ
Поздравляю!
Твой ответ абсолютно правильный
Твой ответ абсолютно правильный
При работе в помещении, в котором проводится опыт, ни в коем случае нельзя есть и пить, так как химические вещества, с которыми проводят опыт, могут быть токсичными или опасными. Они могут попасть на продукты питания или напитки и вызвать отравление или другие негативные последствия для здоровья.



Перед каждым экспериментом обязательно нужно надевать защитные очки и перчатки
Утверждение № 2




Упс!
Кажется, ты ошибся.
Давай разбираться вместе
Кажется, ты ошибся.
Давай разбираться вместе
Отличная работа!
Ты справился на все сто процентов!
Ты справился на все сто процентов!
Перед каждым экспериментом обязательно НУЖНО надевать защитные очки и перчатки. Очки защищают глаза от брызг и осколков, а перчатки предотвращают контакт кожи с опасными химическими веществами.



Все химические вещества должны быть подписаны и храниться в соответствующей таре
Утверждение № 3




Ой, не совсем правильно.
Давай внимательно проверим ответ
Давай внимательно проверим ответ
Замечательно!
Ты ответил на вопрос просто великолепно!
Ты ответил на вопрос просто великолепно!
Да, все химические вещества должны быть подписаны и храниться в соответствующей таре. Это необходимо для безопасности, избежания смешивания и предотвращения опасных химических реакций.



В случае разлива химического вещества необходимо немедленно сообщить об этом взрослым
Утверждение № 4




Ой-ой-ой!
Кажется, ты немного поспешил и выбрал неправильный ответ
Кажется, ты немного поспешил и выбрал неправильный ответ
Поздравляю!
Твой ответ абсолютно правильный
Твой ответ абсолютно правильный
Чтобы быстро устранить опасность и предотвратить возможные травмы или повреждения нужно срочно сообщить взрослым, если ты что-то разлил из химических веществ.



В случае попадания химических веществ на кожу необходимо немедленно промыть это место большим количеством воды
Утверждение № 5




Ты был близок, но, к сожалению,
ответ не совсем верный
ответ не совсем верный
Отличная работа!
Ты справился на все сто процентов!
Ты справился на все сто процентов!
Промывание большим количеством воды помогает быстро удалить химическое вещество с кожи, уменьшая его концентрацию и снижая риск повреждения тканей или всасывания в организм.



При нагревании пробирки с раствором её следует направлять отверстием в сторону окружающих людей
Утверждение № 6




Не совсем верно, но не переживай, ошибки помогают учиться!
Замечательно!
Ты ответил на вопрос просто великолепно!
Ты ответил на вопрос просто великолепно!
При нагревании пробирки с раствором её отверстие НЕ следует направлять в сторону окружающих людей, чтобы избежать возможного выброса содержимого из-за нагревания и образования пара, что может привести к ожогам или травмам.



После завершения эксперимента все использованные инструменты и посуду необходимо вымыть и убрать
на место
на место
Утверждение № 7




Ой-ой-ой!
Кажется, ты немного поспешил и выбрал неправильный ответ
Кажется, ты немного поспешил и выбрал неправильный ответ
Поздравляю!
Твой ответ абсолютно правильный
Твой ответ абсолютно правильный
После завершения эксперимента все инструменты и посуду необходимо вымыть и убрать на место, чтобы поддерживать порядок, предотвратить загрязнение и обеспечить готовность оборудования к следующему использованию.



При нагревании жидкости в пробирке необходимо использовать специальные держатели
Утверждение № 8




Упс!
Кажется, ты ошибся.
Давай разбираться вместе
Кажется, ты ошибся.
Давай разбираться вместе
Отличная работа!
Ты справился на все сто процентов!
Ты справился на все сто процентов!
Использование специальных держателей при нагревании жидкости в пробирке необходимо для обеспечения безопасности и предотвращения ожогов, так как пробирка может нагреться и стать слишком горячей для удержания руками.







Неправильный ответ!
Правильный ответ!







Неправильный ответ!
Правильный ответ!







Неправильный ответ!
Правильный ответ!







Неправильный ответ!
Правильный ответ!







Неправильный ответ!
Правильный ответ!







Неправильный ответ!
Правильный ответ!







Неправильный ответ!
Правильный ответ!







Неправильный ответ!
Правильный ответ!







Неправильный ответ!
Правильный ответ!


Раздел. Концентрация раствора
Концентрация (в массовой доле) показывает, какая часть массы раствора приходится на массу растворённого вещества.
Рассчитывается по формуле:
Рассчитывается по формуле:
mр-ра — масса раствора.
w (концентрация) = mв-ва / mр-ра × 100%
w — массовая доля (концентрация), выраженная в долях (или %, если умножить на 100),
где:


mв-ва — масса растворённого вещества,

Переходи дальше и посмотри пример расчет!



Раздел 1. Концентрация раствора
Концентрация - w , %
В стакан с водой массой
400 г
добавили
100 г
соли
Для расчета массы раствора необходимо сложить массу растворителя (в нашем случае массу воды) и массу растворенного вещества (в нашем случае 100 г соли).
mр-ра = mв-ва + mр-ля

w
(соли) =
m
(соли)
(раствора)
______________
m
* 100 %
m
(раствора) =
100 г.
+
400 г.
=
500 г.
w
(соли) =
100 г.
____________
500 г.
* 100 %
=
20%

400 г
100 г



Раздел 2. Концентрация раствора

Плотность растворителя — это отношение массы жидкости m к её объёму V. Формула для расчёта плотности выглядит так:
ρ= m/V
Рассчитаем плотность раствора серной кислоты (H₂SO₄)
Дано:
Решение:
V
=
(H₂SO₄)р-р
100 мл
m
=
(H₂SO₄)р-р
134 г
Расчет:
ρ
(H₂SO₄)р-р =
m
(H₂SO₄)р-р /
V
(H₂SO₄)р-р
ρ
(H₂SO₄)р-р =
134 г
100 мл
=
1,34 г/мл
/
=
/
ρ
m
V

ρ — плотность растворителя (обычно в кг/м³ или г/см³),
m — масса жидкости,
V — объём жидкости.
m — масса жидкости,
V — объём жидкости.
где:

Задача 1. Смешали 20 г сахара и 220 мл воды. Чему равна концентрация сахара в полученном растворе?

m р-ра (m сахара + m воды)
m сахара
m воды
ω
240 г
9,09%

Неправильно!
Попробуй еще раз!
Попробуй еще раз!
w
(сахара) =
______________
m
(сахара)
(раствора)
m
* 100 %
w
(сахара) =
________
20 г
240 г
* 100 %
=
9,09%

Задача 2. Какую массу соли и воды необходимо взять для приготовления 800 г 4%-ного раствора?

m р-ра (m соли + m воды)
m соли
m воды
ω
32 г
768 г

m
(соли) =
______________
mр-ра
100%
ω
*
m
(соли) =
____________
mр-ра
100%
ω
*
=
9,09%
m
(воды) =
mр-ра
mв-ва
-
m
(воды) =
=
800
32
-
768 г
Неправильно!
Попробуй еще раз!
Попробуй еще раз!


А теперь давайте познакомимся с одной очень удивительной вещью, без которой невозможно представить ни одну химическую лабораторию, ни один химический эксперимент, ни одно открытие по химии - Периодическая система химических элементов Д.И. Менделеева. Это огромный дом химических элементов, где каждый занимает свое место.
Таблица состоит из периодов и групп.
Период - это горизонтальный ряд в периодической системе химических элементов. Обозначается арабскими цифрами : 1, 2, 3, 4 и т.д. Периоды бывают большие и малые. Малые периоды - это 1-3. Большие периоды - это 4-6. Седьмой период считается незавершенным.
Группа - это вертикальный ряд в периодической системе химических элементов. Обозначаются римскими цифрами: I, II, III и т.д.
Нажмите для увеличения

Периодическая система химических элементов Д.И. Менделеева.
Группы делятся на главные и побочные.
Главную подгруппу определяем по второму периоду. Находим элементы второго периода:
Все они располагаются в главных подгруппах (подгруппа А). Соответственно, если элемент находится под одним из этих элементов второго периода, то он также находится в главной подгруппе. Например: Li (литий) — под ним находится Na (натрий), K (калий) и т.д.
Элементы, которые не находятся под элементами второго периода, относятся к побочным подгруппам (подгруппе В). Например, Cu (медь), Ag (серебро) и т.д.
Таким образом, если элемент находится под одним из элементов второго периода, он в главной подгруппе. Если нет — он в побочной подгруппе.
Элементы, которые не находятся под элементами второго периода, относятся к побочным подгруппам (подгруппе В). Например, Cu (медь), Ag (серебро) и т.д.
Таким образом, если элемент находится под одним из элементов второго периода, он в главной подгруппе. Если нет — он в побочной подгруппе.
Нажмите для увеличения
Li (литий), Be (бериллий), B (бор), C (углерод), N (азот), O (кислород), F (фтор), Ne (неон)




1. Каждый элемент обозначается одной или двумя латинскими буквами (символ элемента)
2. Порядковый номер элемента обычно пишется в левом верхнем углу либо сверху посередине
3. Также в ячейке элемента указана его относительная атомная масса
6
Углерод
12,01
С




Порядковый номер
Относительная атомная масса
Символ элемента
Название элемента





Задание 1. Найдите элемент, расположенный в 3 периоде, I группе. Определите его название, химический символ, порядковый номер и атомную массу. Заполни таблицу.
* Подсказка. Атомная масса - это целое число. Числа округляем согласно правилам округления. Например, атомная масса углерода 12,01. Округлив до целого числа получаем 12. А вот атомная масса алюминия 26,98. Согласно правилам округления, получаем, что относительная атомная масса алюминия равна 27. Но нужно запомнить! Единственный элемент, атомная масса которого не округляется - хлор. Его относительная атомная масса равна 35,5.





Все вещества состоят из молекул, молекулы из атомов. А что же такое атом?
Атом - это электронейтральная частица, состоящая из положительно заряженного ядра и вращающихся вокруг отрицательно заряженных электронов. Ядро в свою очередь состоит из протонов (p+) и нейтронов (n0).
Мы уже знаем, как найти порядковый номер химического элемента. А теперь давай запомним, что порядковый номер химического элемента равен числу протонов и электронов. А вот чтобы посчитать число нейтронов нужно от относительной атомной массы отнять порядковый номер химического элемента.
1) Порядковый номер = число (p+) = число (e-)
2) Число нейтронов (n) = атомная масса - порядковый номер
Атом
ядро
протоны
p+
n0
e-
нейроны
электроны
число (p+) = число (e-) = Z








Задание 1. Посчитай число протонов, нейтронов и электронов в атомах: серы (S) и хлора (Cl)
Сера (S)
Протоны
Нейтроны
Электроны
Хлор (Cl)





В химии используются различные типы формул для описания молекул, и две из них — это молекулярная и структурная формулы.
1. Молекулярная формула: она показывает, какие атомы и в каком количестве входят в состав молекулы. Например, молекулярная формула воды:
Это простое и компактное представление, но оно не дает информации о том, как атомы соединены между собой.
H2O





2. Структурная формула: она более детально показывает, как атомы связаны друг с другом в молекуле. Для составления структурных формул необходимо знать валентность - способность атома химического элемента образовывать определенное число химических связей с другими атомами. Для водорода (H) и кислорода (O) валентности равны I и II соответственно. Поэтому структурная формула воды будет изображена как:
O
H
H




А теперь давай попробуем составить структурную формулу серной кислоты (H2SO4). Соедини с помощью химических связей в правильном порядке химические элементы, из которых состоит соединение. Используй следующую подсказку:
Задание выбери правильные химические элементы и подставь в связи
Элемент
Валентность элемента в H2SO4
Водород (H)
Сера (S)
Кислород (O)
VI
I
II






Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева - металлы.
Металлы и неметаллы в периодической таблице Д.И. Менделеева
Обрати внимание, неметаллы в основном живут в IV, V, VI, VII группе ГЛАВНОЙ подгруппе.


Задание. Перетащи каждый элементы в его правильную группу.
Металлы
Неметаллы
F
Au
C
Ag
Br
Ba
N
O
S
Cs
Na
Li
l
Al
Cl
Ca
P
K
Si
Fe



Превращения веществ: химические реакции
Явления, которые происходят с веществами, подразделяют на физические и химические.
Физические явления - явления, при которых изменяется форма тела или агрегатное состояние вещества, но не меняется его состав.
Химические явления - явления, при которых одни вещества превращаются в другие. Химические явления называются также химическими реакциями.
Физические явления
Не происходит изменения состава и строение веществ, вступающих во взаимодействие
Изменение физический свойств:
агрегатного состояния, твердости, теплопроводности
агрегатного состояния, твердости, теплопроводности







Превращения веществ: химические реакции
Явления, которые происходят с веществами, подразделяют на физические и химические.
Физические явления - явления, при которых изменяется форма тела или агрегатное состояние вещества, но не меняется его состав.
Химические явления - явления, при которых одни вещества превращаются в другие. Химические явления называются также химическими реакциями.
Химические явления
Превращение одних веществ (реагентов) в другие отличающиеся по химическому составу или строению (продукты реакции)
изменения цвета
выпадение осадка
растворение осадка
выделение газа
выделение энергии
образование воды
выпадение осадка
растворение осадка
выделение газа
выделение энергии
образование воды







1. Гниение фруктов при длительном хранении
2. Северное сияние
3. Появление изморози на окнах в зимнее время
2. Северное сияние
3. Появление изморози на окнах в зимнее время
ОТВЕТ
Задание 1. Укажите, в ходе какого из приведенных ниже процессов протекает химическая реакция.
Ответ: Протекание химической реакции указано в пункте 1 (Гниение фруктов при длительном хранении), потому что при длительном хранении фруктов в них образуются новые химические вещества.



1. Горение бумаги
2. Потемнение картины
3. Прокатка стали
2. Потемнение картины
3. Прокатка стали
ОТВЕТ
Задание 2. К физическому явлению относится
Ответ: Физическое явление указано в пункте 3 (Прокатка стали), потому что в этом процессе изменяется форма и структура металла под воздействием механических сил без изменения его химического состава.



ОТВЕТ
Задание 3. Из представленных ниже рисунков выберите тот, на котором изображено протекание химической реакции
Рисунок 1
Рисунок 2
Рисунок 3

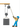

Ответ: Протекание химической реакции изображено на рисунке 2 (горения огня), потому что в ходе реакции горения образуются новые химические вещества.



1. Таяние льда
2. Плавление воска
3. Ржавление железного гвоздя
2. Плавление воска
3. Ржавление железного гвоздя
ОТВЕТ
Задание 4. К физическому явлению не относится
Ответ: Таяние льда и плавление воска. Эти процессы связаны с изменением состояния вещества без изменения его химического состава. Ржавление железного гвоздя является химическим явлением, так как в этом процессе железо вступает в химическую реакцию с кислородом, образуя оксиды железа.


ОТВЕТ

Задание 5. Из представленных ниже рисунков выберите тот, на котором изображено протекание химической реакции
Рисунок 1
Рисунок 2
Рисунок 3



Ответ: Процесс, при котором протекает химическая реакция, изображен на рисунке 2 (повар варит), потому что при приготовлении пищи образуются новые химические вещества.


Все вещества делятся на простые и сложные. Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли.
Классификация неорганических веществ построена следующим образом:
Классификация неорганических веществ построена следующим образом:

Неорганические вещества








Сложные
Неметаллы
Металлы
Простые
Оксиды
Кислоты
Основания
Соли
Далее поговорим подробнее про сложные вещества.



Оксиды — это соединения, состоящие из двух элементов, один из которых всегда кислород, а другой металл или неметалл. Например, угарный газ (CO) — это оксид углерода, вода (H2O) — оксид водорода, оксид натрия Na2O.
Основания — это соединения, которые состоят из атомов металлов и гидроксид-ионов (OH⁻). Например, KOH (гидроксид калия), Al(OH)3 (гидроксид алюминия).
Кислоты — это сложные вещества, состоящие из кислотного остатка (различного состава) и катиона водорода (H+) (положительного иона водорода), которые они способны отдать. Например, серная кислота (H2SO4) или хлороводородная кислота (HCl).
Нажмите для увеличения
Соли — это соединения, которые образуются из атомов металлов и кислотного остатка (различного состава), связанных между собой ионной связью. Например, сульфат натрия (Na2SO4) или хлорид натрия (NaCl).



Задание. Перетащи каждый элементы в его правильную группу.
Кислоты
Оксиды
Основания
Соли
Неметаллы
Металлы
HCl
S
K2SO4
CO2
Al2O3
KOH
Fe(OH)2
O2
CUCl2
N2
HNO3
P
Ag
Zn
Fe
NaCl
H2S
Na3PO4
Mg(OH)2
CuO
SO2
NaOH
Cu
H2SO4



Все оксиды можно разделить на солеобразующие и несолеобразующие. Классификация оксидов:
Солеобразующие
Несолеобразующие
Оксиды


Нажмите для увеличения
Основные оксиды. Это оксиды преимущественно металлов, которые при взаимодействии с водой образуют основания.
Амфотерные оксиды. Эти оксиды обладают особыми свойствами: они одновременно ведут себя и как кислотные, и как основные оксиды.
Кислотные оксиды. Это оксиды преимущественно неметаллов, которые при взаимодействии с водой образуют кислоты (за исключением оксида кремния, он не растворяется в воде).
Амфотерные оксиды. Эти оксиды обладают особыми свойствами: они одновременно ведут себя и как кислотные, и как основные оксиды.
Кислотные оксиды. Это оксиды преимущественно неметаллов, которые при взаимодействии с водой образуют кислоты (за исключением оксида кремния, он не растворяется в воде).



Задание. Перетащи каждый элементы в его правильную группу.
Несолеобразующие оксиды
Амфотерные оксиды
Основные оксиды
Кислотные оксиды
CO2
NO
ZnO
Li2O
CuO
Al2O3
CO
SO3
N2O5
BeO
CaO
Na2O
N2O
NO2



Все основания можно разделить на растворимые и нерастворимые.
Mg(OH)2
Zn(OH)2
Al(OH)2
Cr(OH)2
Zn(OH)2
Al(OH)2
Cr(OH)2
LiOH
NaOH
KOH
Ba(OH)2
Ca(OH)2
NaOH
KOH
Ba(OH)2
Ca(OH)2
Растворимые
(щелочи)
(щелочи)
Нерастворимые


Чтобы понять растворимое соединение или нет, пользуются таблицей растворимости.
Разберемся как ей пользоваться:
Например, мы хотим узнать растворимо или нет соединение KOH. Находим в верхней строке катион калия(K+), сбоку, в столбце, гидррксид-ион(OH-). Пересечение строки катиона и столбца аниона даст информацию о растворимости соединения. В нашем случае гидроксид калия (KOH) - растворим.
Например, мы хотим узнать растворимо или нет соединение KOH. Находим в верхней строке катион калия(K+), сбоку, в столбце, гидррксид-ион(OH-). Пересечение строки катиона и столбца аниона даст информацию о растворимости соединения. В нашем случае гидроксид калия (KOH) - растворим.
Нажмите для увеличения





По классификации кислоты подразделяются на одно-, двух- и трехосновные.
А также по наличию кислорода кислоты можно классифицировать:





В зависимости от состава соли также могут быть разделены на различные группы.
Средние соли — соли, которые состоят из металла и кислотного остатка. Например, карбонат натрия Na2CO3.
Кислые соли — соли, которые содержат в своем составе один или несколько ионов водорода, способных замещаться катионом металла. Например, гидрокарбонат натрия NaHCO3.
Основные соли — соли, которые содержат в своем составе один или несколько гидроксид-ионов, способных замещаться кислотным остатком. Например, гидроксохлорид алюминия Al(OH)Cl2.
Двойные соли — соли, которые содержат в своем составе катионы разных металлов и один тип кислотного остатка. Например, сульфат алюминия-калия KAl(SO4)2.
Комплексные соли — соли, которые содержат в своем составе сложные катионы и анионы, связанные между собой особым типом связи. Например, гексацианоферрат (III) калия K3[Fe(CN)6].
Нажмите для увеличения
Смешанные соли — соли, которые содержат в своем составе разные кислотные остатки и один катион металла. Например, гипохлорит-хлорид кальция CaCl(OCl).





Поздравляем тебя, юный исследователь! Ты прошел долгий и интересный путь, узнавая секреты веществ и законов химии. Надеемся, что твоя страсть к исследованию не угаснет, ведь впереди столько новых открытий и невероятных тайн.
Желаем тебе дальнейших успехов в изучении наук и вдохновения для новых научных приключений.



